实验一 蛋白质的定量测定
双缩脲法
一、原理
凡含有两个以上肽键的化合物在碱性环境下能与硫酸铜结合生成紫色或紫红色复合物,这一反应称为双缩脲反应。
蛋白质是由许多氨基酸通过肽键连接起来的,因而一切蛋白质均可与二缩脲试剂发生颜色反应,且颜色的深浅与蛋白质浓度成正比,这是本法测定蛋白质含量的依据。
二、操作过程
1. 标准曲线的绘制
(1)将已知浓度的蛋白溶液,用生理盐水稀释成10g/L。
(2)取小试管6支,编号按下表操作。
| |
1 |
2 |
3 |
4 |
5 |
6 |
| 标准蛋白溶液(ml) |
0.1 |
0.3 |
0.5 |
0.7 |
0.9 |
0 |
| 生理盐水(ml) |
0.9 |
0.7 |
0.5 |
0.3 |
0.1 |
1.0 |
| 双缩脲试剂(ml) |
4.0 |
4.0 |
4.0 |
4.0 |
4.0 |
4.0 |
混合后,于37℃水浴中放置15分钟,冷却后在520nm波长下比色,以第6管调节零点,测得各管光密度,以各管的光密度值为纵座标,以蛋白质克数为横座标,绘成曲线。
2. 样品测定。
取蛋白样品1ml,加双缩脲试剂4.0ml,于37℃水浴放置15分钟,测其光密度,根据光密度值查标准曲线即得出每100ml血清(样品)中蛋白质的克数。
三、试剂
双缩脲试剂:称取CuSO4·5H2O 2.5g加水100ml,加热助溶,另取酒石酸钾钠10g、碘化钾5g、溶于500ml水中,再加200g/LNaOH 300ml混合,然后将CuSO4溶液倾入,加水至1000ml,此液即可长期保存。
实验二 温度、pH、抑制剂对酶活性的影响
一、目的要求
1. 学习观察酶活性的方法
2. 了解温度、pH、抑制剂对酶活性的影响
二、原理
酶活性的测定实质是测定酶所催化的反应速度,可用单位时间内底物的减少或产物的增加来表示,酶促反应速度受很多因素的影响,主要的因素有酶浓度,底物浓度、pH、温度抑制剂和激活剂等。在研究某一因素对酶促反应速度影响时,应该保持反应中其它因素不变,而仅仅变动待研究的因素。为了准确测定酶活性,必须采用酶促反应动力学中所指的反应初速度,此时的反应速度与酶浓度成正比,可以避免反应产物及其它因素对反应速度的影响。
本实验以碱性磷酸酶为例,以磷酸苯二钠作为底物。在酶的作用下可产生游离酚和无机磷酸盐。酚在碱性条件下与4-氨基安替比林作用。经铁氰化钾氧化,可生成红色的醌衍生物。以比色法根据红色的深浅可测出酚的含量,从而计算出酶的活性,观察温度、pH、底物浓度及抑制剂、激活剂等对酶活性的影响。
反应式如下:
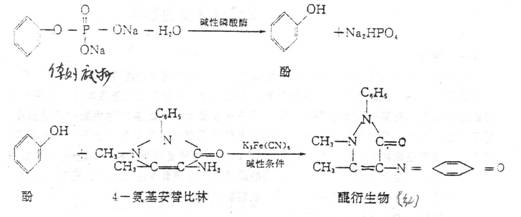
pH对酶促反应速度的影响:
一、原理:
酶促反应速度受溶液pH影响。溶液的pH不但影响酶蛋白的构象和电荷状态也影响底物或辅酶的解离状态,影响酶与底物的结合。若其它条件不变,酶只有在一定的pH范围内才能表现催化活性,且在某一pH下酶的催化活性最大。此pH称为酶的最适pH。各种酶的最适pH不同,体内大多数酶的最适pH在6.5~8.0左右,但也有例外的,如碱性磷酸的最适pH为8.6-10.0,酸性磷酸酶的最适pH在5左右。
本实验在不同pH的甘氨酸缓冲液条件下,测定碱性磷酸酶的活性,从而确定共最适pH。
二、操作
1. 取试管6支,编号按下表操作
| 管号 |
1 |
2 |
3 |
4 |
5 |
6 |
| |
pH7.0 |
pH8.0 |
pH9.0 |
pH10.0 |
pH11.0 |
pH12.0 |
| 甘氨酸缓冲液(ml) |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
| 蒸馏水(ml) |
— |
— |
— |
— |
— |
— |
| 0.02M基质液(ml) |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
| 置37℃水浴中保温5分钟 |
| 血清(ml) |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
2. 立即混匀,在37℃水浴中保温15分钟。
3. 保温结束,每管各加碱性溶液1.0ml,以终止反应。
4. 各管分别加入1.5g/L4-氨基安替比林1.0ml及2.5g/L铁氰化钾2.0ml充分混匀,放置10分钟,直接观察结果,并解释之。
(二)温度对酶促反应速度的影响
一、原理
温度升高对酶促反应产生两种相反的效应:一为反应速度随温度升高而加快,另一方面酶蛋白变性失活的速度,随温度升高也迅速增加。从而使反应速度减慢。这两种效应综合的结果,在某一温度范围内表现出反应速度最大,则此温度称为酶的最适温度。低于最适温度时,变性失活是次要的;而高于最适温度时,变性失活上升为主要因素,结果反应速度逐渐减慢。酶一般在50~60℃以上活性明显降低,80℃以上绝大多数酶丧失全部活性。应该指出,体外实验时酶的最适温度会随着保温时间的长短有所变化。
本实验在不同温度下保温一段时间,观察酶活性的差别。
二、操作
1. 取试管6支,编号按下表操作,加入酶液后,立即混匀,再置各温度下保温(见下表)
| 管号 |
1 |
2 |
3 |
4 |
5 |
6 |
| 0.1mol/LpH10碳酸缓冲液(ml) |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
| 0.02mol/L基质液(ml) |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
| 预温5分钟 |
冰浴 |
室温 |
37℃ |
75℃ |
100℃ |
室温 |
| 血清(ml) |
0.1 |
0.1 |
0.1 |
0.1 |
0.1 |
— |
| 保温15分钟 |
冰浴 |
室温 |
37℃ |
75℃ |
100℃ |
室温 |
2. 保温结束后,立即加入碱性试剂1.0ml,以终止反应。
3. 各管再分别加入1.5g/L4—氨基安替比林1.0ml及2.5g/L铁氰化钾2.0ml,充分混匀,室温下放置10分钟。
4. 直接观察结果,并解释之。
(三)抑制剂对酶促反应速度的影响
一、原理
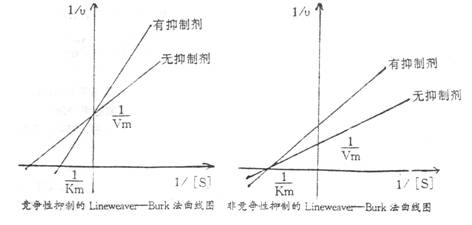
凡能降低酶的活性,甚至使酶完全丧失活性的物质称为酶的抑制剂。抑制剂可分为可逆性和不可抑性两大类。可逆性抑制又可分为竞争性抑制和非竞争性抑制,其作用特点如下:
1. 竞争性抑制:其作用特点是使酶的Km增大,而反应的最大速度Vm不变。
无机磷酸盐为碱性磷酸酶的竞争性抑制剂。
2. 非竞争性抑制:其作用特点是酶的Km不变,而反应的最大速度Vm降低。茶碱为碱性磷酸酶的非竞争性抑制剂。
二、操作
1. 取试管2支,按照下表操作
| 试管 |
测定 |
对照 |
| 0.02mol/L基质液(ml) |
0.5 |
0.5 |
| 0.06mol/L茶碱(ml) |
0.5 |
— |
| 0.1mol/LpH10碳酸缓冲液(ml) |
0.6 |
0.6 |
| 蒸馏水(ml) |
— |
0.5 |
| 于37℃水浴中保温5分钟 |
| 血清(ml) |
0.1 |
0.1 |
2. 37℃保温15分钟后立即加入碱性溶液1.0ml以终止反应。各管分别加入1.5g/L4—氨基安替比林1.0ml及2.5g/L缺氰化钾2.0ml,混匀。置室温10分钟。
3. 比较该实验条件下,抑制剂对酶活性的影响
三、试剂
1. 甘氨酸缓冲液:于50ml 0.2mol/L甘氨酸溶液中按下表加0.2N NaOH。最后加蒸馏水至110ml,配好后用pH计校正。
| pH |
0.2mol/L甘氨酸溶液(ml) |
0.2mol/L NaOH(ml) |
| 8.0 |
50.0 |
1.0 |
| 9.0 |
50.0 |
7.5 |
| 10.0 |
50.0 |
7.5 |
| 11.0 |
50.0 |
48.0 |
| 11.5 |
50.0 |
54.0 |
2. 0.02mol/L基质液:称取磷酸苯二钠·2H2O 5.08g用煮沸冷却的蒸馏水溶解,并稀释至1000ml。加4ml氯仿防腐,盛于棕色瓶中,冰箱内保存,可用一周。
3. 碱性溶液:取0.5mol/L NaOH及0.5mol/L NaHCO3各加20ml,混合后加蒸馏水至1000ml。
4. 1.5g/L4—氨基完全替比林:称取1.5g4—氨基安替比林,用蒸馏水溶解,稀释至1000ml。置棕色瓶中冰箱内保存。
5. 2.5g/L铁氰化钾:称取2.5g铁氰化钾和7.5g硼酸,各溶于400ml蒸馏水,溶解后两液混合,再加水至1000ml,置棕色瓶中,需新鲜配制。
6. 0.1mol/L pH10碳酸缓冲液:称取无水碳酸钠6.36g及碳酸氢钠3.36g。溶解于蒸馏水中,稀释至1000ml,此为0.1mol/LpH10(37℃时)碳酸盐缓冲液。
7. 0.06mol/L茶碱10.8g,溶解于0.1mol/LpH10碳酸缓冲液中,并将此液稀释至1000ml。
四、注意事项
1. 酶学实验要求样品、试剂取量必须准确。
2. 只有在其它条件不变,改变某一因素时,才能准确观察结果,因此要求其它条件一致。
3. 严格按照操作规程进行操作。
实验三 血清蛋白质醋酸纤维素薄膜电脉
一、原理
带电颗粒在电场的作用下,向着与其电荷相反的电极移动,称为电泳。电泳技术已被广泛应用于蛋白质、核酸和氨基酸等物质的分离与鉴定。
蛋白质是两性电解质,各种蛋白质均有一定的等电点,在pH值大于其等电点的溶液中,蛋白质颗粒带负电荷,在电场中向阳极移动。由于各种蛋白质的组成、分子大小与结构不同,它们所带的表面电荷多少也不同,因而在电场中向阳极移动的速度也就不同。经过一定的电泳时间后形成许多蛋白的区带,每一个区带代表一组迁移率相近似的蛋白质。
目前常采用有支持物的区带电泳,如醋酸纤维素薄膜电泳,琼脂糖电泳,聚丙烯酰胺凝胶电泳等,由于支持物不同,分辨率不同,所呈现的电泳图谱也不同。
醋酸纤维是纤维的羟基经乙酰化所形成的纤维素醋酸酯,将它溶于有机溶剂后,涂成均匀薄膜,该薄膜具有均一的泡沫状结构,有强渗透性。采用这种薄膜为支持的的电泳称为醋酸纤维素薄膜电泳。它具有分离速度快,区带清晰,样品用量少操作简便等优点,因而在生化实验室中广泛使用。
血清蛋白质的等电点均低于pH7.0,在pH8.6的巴比妥缓冲液中进行电泳,可将血清蛋白分为清蛋白、α1、α2、β及γ-球蛋白等五条区带。
将各个区带剪开,分别用0.4mol/L NaOH洗脱,或直接扫描,即可测得各种蛋白质的百分含量。
二、操作
1. 准备:将薄膜切成8×2cm的小条,在薄膜无光泽面距一端1.5cm处,用铅笔轻划一条线,表示点样位置,同时写一编号,以便区别。将薄膜在巴比妥缓冲液中充分渗透(约20分钟)后,取出,用滤纸吸去表面多余水分,膜粗面朝上放。
2. 点样:取一滴样品(血清)放置在载玻片上,用盖玻片的一端截面(玻片宽度应小于薄膜的宽度),沾适量的样品(样品吸附高度约1~2nm,高度均一),然后将其截面与薄膜上点样线处轻轻接触,样品呈一条线“印”在薄膜上,使样品量点得细窄而均匀,印的位置要适中,勿偏近薄膜某一边缘,或超过两边边缘。
3. 电泳:将已点好样品的薄膜架在电泳槽的纸桥支架上,无光泽面朝下,使点样端靠近卫极,加盖,平衡5-10分钟。按通电源,调节电压110-150V,电流为0.4-0.6mA/cm膜宽,通电45-70分钟后关闭电源,停止电泳。
4. 染色与漂洗:将薄膜从电泳槽中取出,直接浸入氨基黑染色液中,染色3分钟。移入5%醋酸漂洗液中漂洗3-4次,每次5分钟,使薄膜背景完全脱色为止。取出,用滤纸吸去多余液体,观察血清电泳区带。
三、试剂:
1. pH8.6巴比妥缓冲液:称取巴比妥钠12.76克,巴比妥1.66克,用蒸馏水加热溶解后,再加水至1000ml.
2. 氨基黑染色液:取氨基黑10 B 0.5克溶解于50ml甲醇中,再加冰醋酸10ml及水40ml。
3. 漂洗液:量取95ml/L乙醇45ml,加冰醋酸5ml,水50ml混匀。
临床意义:参见理论讲义血液章。
实验四 血清谷——丙转氨酶(SGPT)活性测定
原理
谷——丙转氨酶(GPT)催化下列反应:
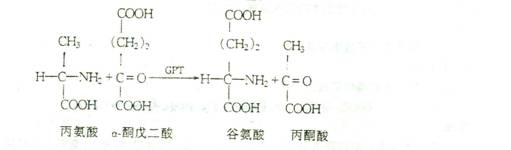
反应产物丙酮酸与2.4一二硝基苯肼作用生成丙酮酸—2.4一二硝基苯腙,它在碱性环境中呈棕绝色。
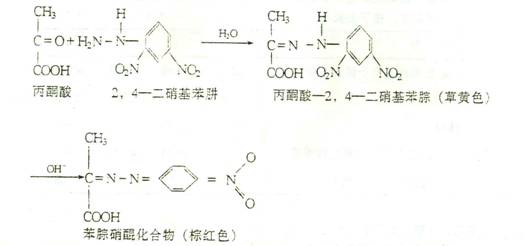
这样可以利用比色法测定反应所生成的丙酮酸量,并以此反映谷—丙转氨酶活性的高低。
临床上一般规定每百毫升血清与基质在37℃保湿30分钟后,产生1微克分子丙酮酸为1单位。正常人血清GPT低于100单位/dl血清(80~120单位/dl血清)。本法为金氏法单位。1986年7月1日起,我国正式施行《中国人民共和国计量法》,即法定单位,为nmol/(S·L)。现习惯使用的单位要逐渐向法定单位过度,在过度期间,惯用单位仍可在日常使用,但正式文献必需换算成法定单位。
操作
取试管两支分别注以“测定管”和“对照管”,按下表操作。
| |
测定管 |
对照管 |
| 血清(ml) |
0.1 |
- |
| GPT|基质(ml) |
0.5 |
0.5 |
| 混匀,置37℃水浴保湿30分钟 |
| 2.4一二硝基苯肼(ml) |
0.5 |
0.5 |
| 血清(ml) |
- |
0.1 |
| 混匀,置37℃水浴保湿20分钟 |
| 0.4N NaOH (ml) |
5.0 |
5.0 |
| 混匀,放置10分钟比色 |
用520nm波长或绿色滤光片比色,以蒸馏水作空白管,读取测定管和对照管的光密度值,然后测定管光密度减去对照管光密度,所得关值查标准曲线求出100ml血清的酶活性单位。
2、标准曲线的制作:
取试管6只,按下表加试剂:
| 管号 |
0 |
1 |
2 |
3 |
4 |
5 |
| 丙酮酸钠标准液(ml) |
0 |
0.05 |
0.10 |
0.15 |
0.20 |
0.25 |
| GPT基质液(ml) |
0.5 |
0.45 |
0.40 |
0.35 |
0.30 |
0.25 |
| 相当于每100ml血清中酶活性单位数 |
0 |
100 |
200 |
300 |
400 |
500 |
分别向各管加蒸馏水0.1ml,2.4一二硝基苯肼0.5ml,在37℃保温20分钟后加入0.4mol/L NaOH 5ml,混匀10 分钟后按前述方法比色。
从1~5管的光密度值中减去0管的光密度值,以此光密度差为纵坐标,上表中所示酶活性单位为横坐标,绘制标准曲线如下:
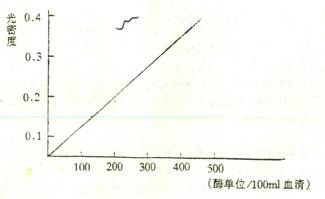
血清GPT测定标准曲线
实验五 生物氧化
(一)氧化酶
原理
氧化酶是直接利用分子氧促进基质氧化的酶,其中最典型的酶是酪氨酸酶。酪氨酸酶催化酪氨酸氧化生成黑色素。
酪氨酸含在新鲜蘑菇、马铃薯(马铃薯根茎的外层),甜萝卜、谷物及其它物质中
试剂
酪氨酸溶液:取酪氨酸0.1克溶于200毫升1g/LNa2CO3溶液中,如需可在水浴上加热以助溶。
操作
1、取马铃薯一个用水将表面洗净,削下表皮层切成小块,放入乳钵中加入蒸馏水5毫升,用乳钵研碎,纱布过滤泌出溶液。
2、取酪氨酸溶液2毫升于试管内,加马铃薯滤液2毫升,摇匀并置35—40 水浴箱中。
3、时时振荡试管使空气氧能与溶液充分接触,此时溶液逐渐转为蔷薇红色、褐色、最后(约径1—2小时)变为黑色。
(二)过氧化氢酶
原理
过氧化氢酶广泛地存在于支票物组织中,过氧化氢酶能催化过氧化氢分解产生水和氧气。
2H2O2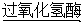 2H2O+O2↑
2H2O+O2↑
本实验是利用氧气的助燃性来观察过氧化氢酶的作用。
试剂
1、30ml/L过氧化氢溶液。
2、新鲜肝脏。
操作
取约0.5克肝组织(约黄豆大小)置于试管底部,迅速向试管中加入30ml/L过氧化氢20滴,观察有无气泡产生,用拇指盖肾管口片刻,然后迅速放开拇指,立即把即将吹灭火焰但存有余烬的火柴置于管口,观察有何现象,并说明之。
(三)过氧化酶
原理
过氧化酶可以催化H2O2直接氧化酚类和胺类的质,例如:氧化焦性没食子酸生成焦没食橙(橙红色),氧化愈创木脂生成兰色化合物。
试剂
1. 10g/L焦性没食子酸水溶液。
2. 30ml/LH2O2。
3. 10g/L愈创木脂酒精溶液。
4. 0.005mol/L Na2CO3溶液。
操作
1. 白萝卜提取液:取白萝卜10克,加0.005mol/L Na2CO3溶液10毫升,研碎用棉花过滤,收集滤液备用。
2. 取白萝卜提取液4毫升于试管中,煮沸3分钟,冷却后备用。
3. 取试管四支,按下表操作
| 试管 |
1 |
2 |
3 |
4 |
| 10g/L焦性没食子酸水溶液 |
60滴 |
60滴 |
60滴 |
60滴 |
| 30ml/L H2O2溶液 |
2滴 |
— |
2滴 |
2滴 |
| H2O |
40滴 |
2滴 |
— |
— |
| 白萝卜提取液(过氧化酶溶液) |
— |
40滴 |
40滴 |
— |
| 煮沸过的白萝卜提取液 |
— |
— |
— |
40滴 |
混匀,观察各管颜色的变化
4. 再取试管两支,按下一操作
| 试管 |
1 |
2 |
| 1g/L愈创木脂酒精溶液 |
10滴 |
10滴 |
| 30ml/LH2O2溶液 |
10滴 |
10滴 |
| 白萝卜提取液 |
10滴 |
— |
| 煮沸过的白萝卜提取液 |
— |
10滴 |
混匀,观察各管颜色的变化。
实验六 维生素C的定量测定
1. 原理
抗坏血酸在体外很不稳定,易被氧化成脱氢抗坏血酸。脱氢抗坏血酸仍保留维生素C的生物活性,在动物组织内脱氢抗坏血酸可被谷胱甘肽等还原成抗坏血酸。在pH5以上时,脱氢抗坏血酸易将其分子构造重新排列使其内酯环裂开,生成没有活性的二酮古洛糖酸。三者台称为总维生素C。
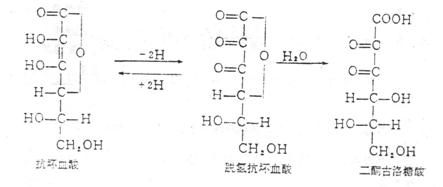
测定原理是首先将样品中还原型的抗坏血酸氧化成脱氢抗坏血酸,脱氢抗坏血酸和二酮古洛糖酸都能与2,4-二硝基苯肼作用生成红色的苯棕。苯棕的生成量与总抗坏血酸量成正比。最后将溶于硫酸,再与同样处理的抗坏血酸标准液比色。以求出样品中的总抗坏血酸的含量。
2. 操作过程
①提取:称取白菜2g置研钵中,加少量10g/L草酸,研磨5~10分钟,将提取液收集至50ml容量瓶中,如此重复提取2~3次,最后加1g/L草酸到刻度(总体积50ml)。
②氧化、脱色:将提取液约10ml倒入干燥锥形瓶中,加入半匙活性炭,充分振摇1分钟后过滤。取约10ml维生素C标准液(10mg/L)于另一干燥锥形瓶中,加入半匙活性炭,同法过滤处理。
③显色:取中号试管3支,按下表操作:
| 试剂(ml) |
空白 |
标准 |
测定 |
| 样品滤液 |
2.5 |
— |
2.5 |
| 标准液(10mg维生素C/L) |
— |
2.5 |
— |
| 100g/L硫脲(滴) |
1 |
1 |
1 |
| 20g/L2,4-二硝基苯肼 |
— |
1.0 |
1.0 |
| 混匀,置沸水浴中10分钟后,流水冷却 |
| 20g/L2,4-二硝基苯肼 |
1.0 |
— |
— |
| 85% H2SO4 |
3.0 |
3.0 |
3.0 |
注意:加80%H2SO4时,需逐滴慢加,并将试管于冷水中,边加边摇冷却。加完后混匀,静置10分钟,以空白调零,用500nm波长比色。
3. 计算
维生素C mg/100克样品= ×0.01×2.5×
×0.01×2.5×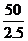 ×
×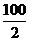
注:
①0.01为标准液中每ml含维生素C mg数(即10ml/L,再乘以2.5为标准液共加入2.5ml)。
②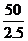 为样品加入2.5ml,而2克样品提取液总体积为50ml。
为样品加入2.5ml,而2克样品提取液总体积为50ml。
③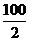 为样品取2克,换算成100克时维生素C的含量。
为样品取2克,换算成100克时维生素C的含量。
4. 注意事项
①提取物除新鲜白菜外,也可采用新鲜桔子汁、鲜枣、鲜辣子、蕃茄汁等新鲜水果、蔬菜。按实验进行季节灵活选用。
②本法也适用于血浆、血清、全血及尿中维生素C测定,测定尿中维生素时,按下方式操作:取尿1ml,加40g/L三氯醋酸19ml,活性炭0.5克,振摇后过滤,取滤液2.5ml,按本法操作③显色及注意进行。
③加硫脲的目的是提供轻度还原环境,此防止维生素C被2,4-二硝基苯肼氧化,并阻止2,4-二硝苯肼与Fe+3及其它氧化剂产生颜色,造成干扰。
④沸浴前试管要作标记,沸浴中注意安全,沸浴后同学间勿拉乱试管。
⑤提取维生素C,若容量瓶不足,可全班一起提取。
⑥使用80%硫酸应小心,仔细,防止损伤人、物及仪器。
5. 试剂
①10g/L草酸溶液。
②4.5mol/L H2SO4溶液:谨慎地加250ml浓硫酸(比重1.84)于700ml蒸馏水中,冷却后稀释至1000ml。
③20g/L2.4-二硝基苯肼溶液:溶解2,4-二硝基苯进2g于4.5mol/L硫酸100ml内,过滤。不用时放入冰箱内,每次用前必须过滤。
④850g/LH2SO4:谨慎地加900ml硫酸(比重1.84)于100ml蒸馏水中。
⑤100g/L硫脲:溶解50g硫脲于500ml 1%草酸中。
⑥活性炭:100g活性炭加1mol/L HCl 750ml中回流加热1小时,过滤。和蒸馏水洗涤数次至滤液中无Fe3+为止,然后置于110℃烘箱中烘干。
⑦抗坏血酸标准储存液:溶解100mg纯抗坏血酸于100ml 10g/L草酸中。
⑧抗坏血酸标准应用液(0.01mg/ml维生素C):取储存液1.0ml用1%草酸稀释至100ml。
实验七 尿中淀粉酶活性的测定(Winslow氏法)
原理
血清及尿中的淀粉酶来源于胰腺和唾液腺,正常血清与尿中此酶有一定活性。Winslow氏法测定尿和血清中淀粉酶活性是将试样作等比稀释,观察一系列稀释试样在规定的37℃,30分钟的实验条件下,恰好能将0.1%淀粉溶液1ml水解(指加入碘液后不在呈蓝色)的酶量定为淀粉酶的一个活性单位。乘以尿的稀释倍数,即可得知每毫升尿的酶活性。
试剂
1. 9g/LNaCl
2. 3g/L碘液
3. 1g/L淀粉溶液
操作
1. 取10个15×150mm试管,编号,用吸管向各管加入9g/LNaCl 1ml。
2. 用1ml吸管于第一管中准确吸加尿液1ml,混合。再将试管中的液体吸起,然后任其流回试管,如此重复三次,以便全管混匀,并借此冲洗吸管内壁。吸出此混合液1ml移入第二试管中。
3. 用同法处理第二管使之混匀,并取出1ml置于第三管中。依次类推,如此继续稀释至第九管,吸出1ml混合液弃去之,这样即可获得分别含原尿液为1/2,1/4,1/3…1/512mol的不同浓度的尿稀释液。第十管不如尿液作为对照管。
4. 从第10管起(为何不从第一管起?)依次迅速准确加入1g/L淀粉液2ml,迅速摇匀(是否充分混匀往往是实验成败的关键!)立即置37℃水浴中,准确保温30分钟。
5. 取出各管,立即向各管中加入3g/L碘液2滴摇匀,观察各管的颜色。
各管依次出现黄到蓝的色序,黄色表明无淀粉存在,浅红色到紫色表明有淀粉的水解中间产物,蓝色表明有淀粉存在。
计算
应选择无蓝色管中尿稀释倍数最大的一管来计算。假如无蓝色的一管理为第五管(则第六管为蓝色),已知在第五管中含尿液1/32ml,即尿液能在37℃,30分钟水解0.1%淀粉2ml。
求出1ml尿液水解0.1%淀粉Xml。
1/32:2=1:X
X=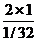 =2×32=64ml
=2×32=64ml
即每ml尿液中所含淀粉酶的活性为64个单位。
正常值:8—64单位
临床意义:胰腺炎、腮腺炎、胆道疾病时尿淀粉酶活性增高。
