质粒的提取
1. 柱平衡步骤:向吸附柱CP3中(吸附柱放入收集管中)加入500ul的平衡液BL,12000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中。(请使用当天处理过的柱子)
2. 取1-5ml过夜培养的菌液,加入离心管中,12000rpm离心1分钟,尽量吸出上清(菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。
3. 向留有菌体沉淀的离心管中加入250ul溶液P1,使用移液器或涡旋振荡器彻底悬浮细菌沉淀。
注意:如果有未彻底混匀的菌块,会影响裂解,导致提取量和纯度偏低。
4. 向离心管中加入250ul溶液P2,温和的上下翻转6-8次使菌体充分裂解。
注意:温和的混合,不要剧烈振荡,以免打断基因组DNA,造成提取的质粒中混有基因组DNA片段。此时菌液应变得清亮粘稠,所用时间不应超过5分钟,以免质粒受到破坏。如果未变得清亮,可能由于菌体过多,裂解不彻底,应减少菌体量。
5.向离心管中加入350ul溶液P3,立即温和地上下翻转6-8次,充分混匀,此时将出现白色絮状沉淀。12000rpm离心10分钟,此时在离心管底部形成沉淀。
注意:P3加入后应立即混合,避免产生局部沉淀。如果上清中还有微小白色沉淀,可再次离心后取上清。
6.将上一次收集的上清液用移液器转移到吸附柱CP3中(吸附柱放入收集管中),注意尽量不要吸出沉淀。12000rpm离心30-60秒,倒掉收集管中废液,将吸附柱CP3放入收集管中。
7.可选步骤:向吸附柱CP3中加入500ul去蛋白液PD,12000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3重新放回收集管中。
如果宿主菌是endA+宿主菌(TG1,BL21,HB101,JM系列,ET12567等),这些宿主菌含有大量的核酸酶,易降解质粒DNA,推荐采用此步。
如果宿主菌是endA-宿主菌(DH5α,TOP10等),这步可省略。
8.向吸附柱CP3中加入600ul漂洗液PW,12000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3放入收集管中。
9.向吸附柱CP3中加入600ul漂洗液PW,12000rpm离心30-60秒,倒掉收集管中的废液。
10. 将吸附柱CP3放入收集管中,12000rpm离心2分钟,目的是将吸附柱中残余的漂洗液去除。
注意:漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。为确保下游实验不受残留乙醇的影响,建议将吸附柱CP3开盖,置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
11. 将吸附柱CP3置于一个干净的离心管中,向吸附膜的中间部位滴加50-100ul洗脱缓冲液EB,室温放置2分钟,12000rpm离心1分钟将质粒溶液收集到离心管中。
12. 电泳检测或保存于-20冰箱
PCR-RFLP检测内皮一氧化氮合酶(NOS3)基因多态性
【背景介绍】
PCR-RFPL
DNA分子水平上的多态性检测技术是进行基因组研究的基础。RFLP(Restriction Fragment Length Polymorphism,限制片段长度多态性)已被广泛用于基因组遗传图谱构建、基因定位以及生物进化和分类的研究。RFLP是根据不同个体基因组的限制性内切酶的酶切位点碱基发生改变,或酶切位点之间发生了碱基的插入、缺失,导致酶切片段大小发生了变化,这种变化也可以通过特定探针杂交进行检测,从而可比较不同个体的DNA水平的差异(即多态性)。
内皮—氧化氮合酶(NOS3)基因多态性与高血压
一氧化氮合酶(NOS)是一种催化小分子信息化合物——一氧化氮(Nitric Oxide)生成的酶,它广泛参与免疫调节、神经传递、血压生理调控和血小板凝聚的抑制等多种生理功能。与高血压、糖尿病肾病等多种疾病的发生密切相关。NOS可分为三型:神经元型、诱导型、内皮型。内皮型一氧化氮合酶由内皮型一氧化氮合酶(NOS3,又称为eNOS)基因在人类染色体上定位于7q35~7q36区域,跨度约21kb,含有26个外显子和25个内含子,相应的信使核糖核酸(mRNA)约4.1kb,翻译生成含1203个氨基酸的蛋白产物。
近年来已知NOS3的3个基因多态性位点与原发性高血压(EH)的关系。
1. 位于第4内含子上27bp数目可变的串联重复序列(VNTR),根据重复次数不同有两种等位基因,重复4次为a等位基因,重复5次为b等位基因。
2. 位于第8外显子上,由于894位碱基G突变成T(G894T, 即rs57135373),导致相应蛋白产物第298位上的谷氨酸被替换成天冬氨酸(Glu298Asp),突变前后的等位基因分别成为G、T等位基因。
3. 位于5端侧翼区上786位碱基T突变成C(T786C),突变前后的等位基因分别为T、C等位基因。
G894T多态性
1.与血管痉挛的关系:最近的研究显示带有G894T的NOS3基因转染细胞后可以分裂成100Kda和35Kda的两个片段,影响NOS3的功能导致NOS3合成减少或功能下降,NO减少,冠状动脉紧张性升高诱发冠状动脉痉挛。这些研究说明,NOS3的G894T多态性可能影响血管内皮功能,使外周血管阻力增加,导致原发性高血压。
2.与原发性高血压的关系:1998年Lacolley等在法国高加索人中首次对G894T变异与原发性高血压关系进行研究,发现原发性高血压组中G等位基因频率显著高于对照组。Miyamoto等对日本京都和熊本两个独立人群的研究结果正好与Lacolley相反,原发性高血压组T等位基因频率显著高于对照组,提示T等位基因是日本人原发性高血压的危险因子。Shoji等研究了183例原发性高血压患者和193例正常对照者,发现NOS3的G894T变异与原发性高血压相关,具有G894T等位基因的原发性高血压患者比没有变异等位基因的舒张压和平均动脉压明显增高。
【目的】
本实验将综合运用微量全基因组DNA的提取,PCR-RELP的酶切,琼脂糖凝胶电泳技术,进行高血压内皮一氧化氮合酶(NOS3)基因多态性的检测。
实验一 组织基因组DNA的提取
【原理】
应用可以特异性结合DNA的离心吸附柱和独特的缓冲液系统,提取多种细胞中的基因组DNA。离心吸附柱中采用硅基质材料,高效、专一吸附DNA,可最大限度去除杂质蛋白及细胞中其他有机化合物,提取的基因组DNA片段大,纯度高,质量稳定。
DNA提取得率:
| 材料 |
提取量 |
DNA得量 |
| 全血 |
100ul-1ml |
3-30ug |
| 动物细胞培养液 |
106-107cell |
5-30ug |
| 动物组织 |
30mg |
10-30ug |
| 细菌培养液 |
108-1010cell |
5-20ug |
【试剂和耗材】
蛋白酶K(储存于-20℃);缓冲液GA;缓冲液GB;去蛋白液GD;漂洗液GW;吸附柱CB;洗脱缓冲液TE;无水乙醇。
Tip头;枪头盒;1.5ml Ep管;离心管盒。
【仪器】
移液器;高速离心机;振荡器;水浴箱。
【操作步骤】
1. 取一个1.5ml离心管,加入100ul缓冲液GA,用棉签尾(无药棉头)在口腔颊部来回擦试1-2min,将擦试头插入GA缓冲液中洗涤,用新棉签重复,共四次。
2. 加入10ul蛋白酶K溶液,在涡旋混匀器上混匀,10s。
3. 加入110ul缓冲液GB,涡旋混匀器上混匀,70℃放置10min。
4. 加入110ul无水乙醇,涡旋混匀器上混匀,10s。
5. 将上一步所得的溶液加入一个吸附柱CB中,12000rpm,30s,弃废液(不换离心管)。
6. 将GD250ul加入吸附柱中,12000rpm,30s,弃废液(不换离心管)。
7. 将PW350ul加入吸附柱中,12000rpm,30s,弃废液(不换离心管)。
8. 将PW250ul加入吸附柱中,12000rpm,30s,弃废液(不换离心管)。
9. 再次12000rpm,2min,尽量除去漂洗液。
10. 将吸附柱CB转入一个干净的离心管中,加入预温的洗脱缓冲液TE(70℃)60ul混匀,室温放置5min,12000rpm,3min。
11. 溶液-20℃冻存或4℃保存,待用。
【注意事项】
1. 取内皮细胞时,用力适度,不能太轻,但也要防止出血。
实验二 聚合酶链式反应
(ploymerase chain reaction, PCR)
【原理】
PCR技术实际上是在模板DNA、脱氧寡核苷酸引物和4种dNTP底物存在的条件下依赖于DNA聚合酶进行的酶促合成反应。PCR技术的特异性取决于引物和模板DNA结合的特异性。
PCR全过程包括三个基本步骤:即双链DNA模板加热变性成单链(变性);低温条件下引物与单链DNA互补配对(退火);在适宜的温度下DNA聚合酶催化引物沿着模板DNA延伸(延伸)。这三个步骤构成的步骤循环进行,35个循环可使特异性模板DNA扩增235倍。
循环的温度和时间;变性94℃,30-60s;延伸72℃,30-90s;退火温度为引物Tm,30-60s,(根据要扩增的靶DNA片段的大小来确定各阶段的时间)
TaqDNA聚合酶:耐热---72℃活性最高,95℃仍有活性,可以提高退火和延伸的温度(大于50℃),以利于引物与模板的精确配对。
引物:15-30碱基,Tm=4(G+C)+2(A+T)。过短使扩增的特异性降低,过长使扩增的效率降低。
本实验使用引物序列如下:
G894T 上游 5’ AAGGCAGGAGACAGTGGATG 3’
G894T 下游 5’ AGGATGTTGTAGCGGTGAGG 3’
扩增产物长:498bp
【试剂和耗材】
ddH2O;
模板:使用合适方法制备的模板DNA;
TaqDNA聚合酶:浓度为2.5U/μl;
引物:浓度为0.1-0.5mmol/L过高会引起错配和引物的浪费;
底物:浓度为dATP、dGTP、dCTP、dTTP各200mmol/L,
过高会抑制TaqDNA聚合酶活性;
10×反应缓冲液:500mmol/L KCL、100mmol/L Tris·CL(PH8.4、室温,PH7.1、72℃)、15mmol/L、MgCL2、0.5%Tween-20。
Tip头;枪头盒;0.2ml EP管;1.5ml EP管。
【仪器】
DNA扩增仪;移液器。
【操作步骤】
1. 制备反应体系:取一只0.2ml无菌Eppendorf管依次加入:
| 方案一 |
|
方案二 |
|
| ddH2O |
15.5μl |
ddH2O |
7.5μl |
| 10×buffer |
2.5μl |
Taq Mix |
12.5μl |
| dNTP |
1.0μl |
Primerl |
1.0μl |
| Primerl |
1.0μl |
Primer2 |
1.0μl |
| Primer2 |
1.0μl |
DNA |
3.0μl |
| Taq |
1.0μl |
总体积 |
25.0μl |
| DNA |
3.0μl |
|
|
| 总体积 |
25.0μl |
|
|
2. 震荡混均后,离心10s。
3. 将小管放入PCR仪中,设置程序:
PCR扩增程序:
95℃ 2 min。
94℃ 30s;63℃ 30s;72℃ 45s;共35个循环。
72℃ 7min。
4℃ ∞ (可省略)
4. 运行程序。
5. 程序结束后,取出小管,放入-20℃冰箱冻存。
【注意事项】
1. 所有器具要专用,高压处理,尽量一次性使用;
2. 试剂专用、专存、所有试剂要分装成小份后独立保存,每次剩余的试剂要丢弃;
3. 分装到小管的试剂使用前要离心10-30s;
4. 最后向反应管加模板DNA,并离心10s;
5. 非即用管都应盖严;
6. 勤换手套,接触过模板必须换手套;
7. 上、下游引物必须严格分离。
实验三 限制性酶切分析
【原理】
DNA纯度、缓冲液、温度条件及限制性内切酶本身都会影响限制性内切酶的活性。大部分限制性内切酶不受RNA或单链DNA的影响。如果采用两种限制性内切酶,必须分别提供各自最适盐浓度。若可用同一缓冲液,则可同时水解。若需要不同的盐浓度,则低盐浓度的限制性内切酶必须首先使用,随后调节盐浓度,再用高盐浓度的限制性内切酶水解。也可在第一个酶切反应完成后,用等体积酚/氯仿抽提0.1倍体积3mol/LNaAc和2倍体积无水乙醇,混匀后置-70℃低温冰箱30分钟,离心、干燥、重新溶于缓冲液后进行第二个酶切反应。
 BanⅡ的酶切序列: G GGCC C
BanⅡ的酶切序列: G GGCC C
C CCGG G
多态性位点为T时,限制性酶切位点消失:TGGCCC
ACCGGG
PCR产物经BanⅡ酶切后出现3种带型:
T/T纯合子不会被切断,酶切后电泳条带为498bp;
G/G纯合子酶切后电泳条带为338bp与160bp;
T/G杂合子酶切后电泳条带为498bp、338bp与160bp。
【试剂和耗材】
限制性内切酶BanⅡ及10×酶切缓冲液;0.2ml Ep管。
【仪器】
PCR仪或恒温水浴箱。
【操作步骤】
1.取一只0.2ml Eppendorf管,按下表加入试剂并混匀:
| 灭菌水 |
7μL |
| 10×酶切缓冲液 |
2μL |
| BanⅡ |
1μL |
| PCR产物 |
10μL |
| 总体积 |
20μL |
2.震荡混匀后,瞬时离心。
3.于37℃保温3小时以上或过夜。
4.酶切结束后,在65℃保温10分钟终止反应。
5.取出反应管,放入-20℃冰箱冻存。
【注意事项】
1.所有Ep管和Tip头都要使用新的,经高压灭菌,一次性使用。
2.待用的酶要放在冰浴内,用后盖紧盖子,立即放回-20℃冰箱,防止酶被污染或失活。
3.未酶切的DNA要防止发生降解,酶切反应一定要彻底。
实验四 琼脂糖凝胶电泳
【原理】
核酸在pH高于其等电点的溶液中带负电荷,在电场中向正极移动。琼脂糖凝胶具有多孔的网状结构,以其为介质电泳时,不同大小的核酸可借凝胶的分子筛作用而得以分开。用溴化乙锭染色后,在紫外灯下,可见染成橘红色的核酸条带。琼脂糖凝胶常制成水平平板状,电泳缓冲液覆盖在平板表面,加样后,再通电电泳,故又称为潜水式电泳。
【试剂和耗材】
琼脂糖;6×上样缓冲液;1×TAE电泳缓冲液;10mg/ml溴化乙锭(EB);
50×TAE:
Tris 242g
冰醋酸 57.1ml
0.5mol/L EDTA 100ml(pH8.0)
用蒸馏水溶解后,定容至1000ml。
【仪器】
低压电泳仪;水平电泳槽;凝胶自动成像与分析系统(或紫外检测仪、照相机)。
【操作步骤】
1.制备琼脂糖凝胶:用透明胶带纸将制胶模具两端封好,选择加样孔径小适宜的梳板,垂直架在模具的一端,使点样梳板底部离模具水平面的距离为1.0mm左右。按照被分离的DNA分子的大小决定凝胶中琼脂糖的百分含量(一般为1.5%)。称取一定量的琼脂糖,溶解在电泳缓冲液1×TAE中,置微波炉中加热至琼脂糖深化均匀。
2.在凝胶中加入溴化乙锭(终浓度为0.5μg/ml),摇匀,待凝胶溶液冷却至50℃左右时,轻轻倒入制胶模具中,除去气泡。凝胶厚度一般为0.3~0.5cm,于室温下冷却凝固。
3.待凝胶冷却凝固30分钟后,撕去封于模具两端的透明胶带纸,将其与凝胶一起放入电泳槽内。在电泳槽内加入电泳缓冲液1×TAE,使电泳缓冲液刚好盖过胶面,然后小心取出点样梳板,注意保持点样孔的完好。
4.待测的DNA样品(基因组DNA;PCR产物;酶切产物)与1/5体积的上样缓冲液混匀后点样进行电泳,记录样品次序与点样量,在样品的一侧的点样孔中加入分子量标准。
5.打开电源开关,选择适当的电压进行电泳,最高电压不高于5V/cm,当琼脂糖浓度低于0.5%时,电泳时温度不能太高。
6.电泳时间据实验具体要求而定,一般电泳30-60分钟即可。
7.电泳至所需时间,停止电泳。
8.取出凝胶直接在紫外透射仪上观察及绘图记录或照相。
【注意事项】
1.溴化乙锭为强诱变剂,中等毒性。操作时应戴手套,并避免污染实验台面。
2.PCR与电泳的一切用具必须严格分开。
3. 取出点样梳板前应确保凝胶已完全凝固。如天气太热,可将凝胶放于4℃冰箱帮助成胶。
(杨旭东 马 捷)
附:凝胶成像照片
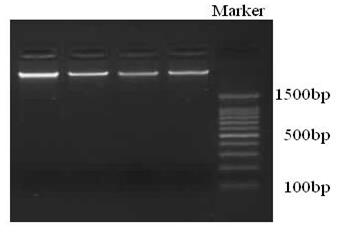
图1:基因组DNA琼脂糖凝胶电泳图像
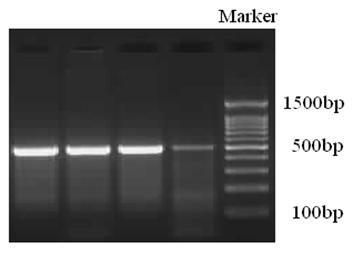
图2 PCR产物琼脂糖凝胶电泳图像

图3 酶切产物琼脂糖凝胶电泳图像
